
予防接種を支える仕組み(1)
ワクチンが開発・承認され、必要な人に安全に接種される過程について、詳しく見てみましょう。
新ワクチンの開発の流れ

様々な試験で安全性・有効性を確認する
上の図は、新ワクチンの開発の一連の流れを示したものです。新ワクチンは、非臨床試験・臨床試験を経て安全性・有効性が確認されれば、製造・販売の承認を得ることができます。
参考:ICHガイドライン E8(1998),「臨床試験の一般指針について(医薬審第 380 号)」
厚生労働省医薬食品局審査管理課長通知(2010),「感染症予防の非臨床試験ガイドライン」(薬食審査発0527第1号)
厚生労働省医薬食品局審査管理課長通知(2010), 「感染症予防の臨床試験ガイドライン」(薬食審査発0527第5号)
ワクチンの薬事承認の流れ
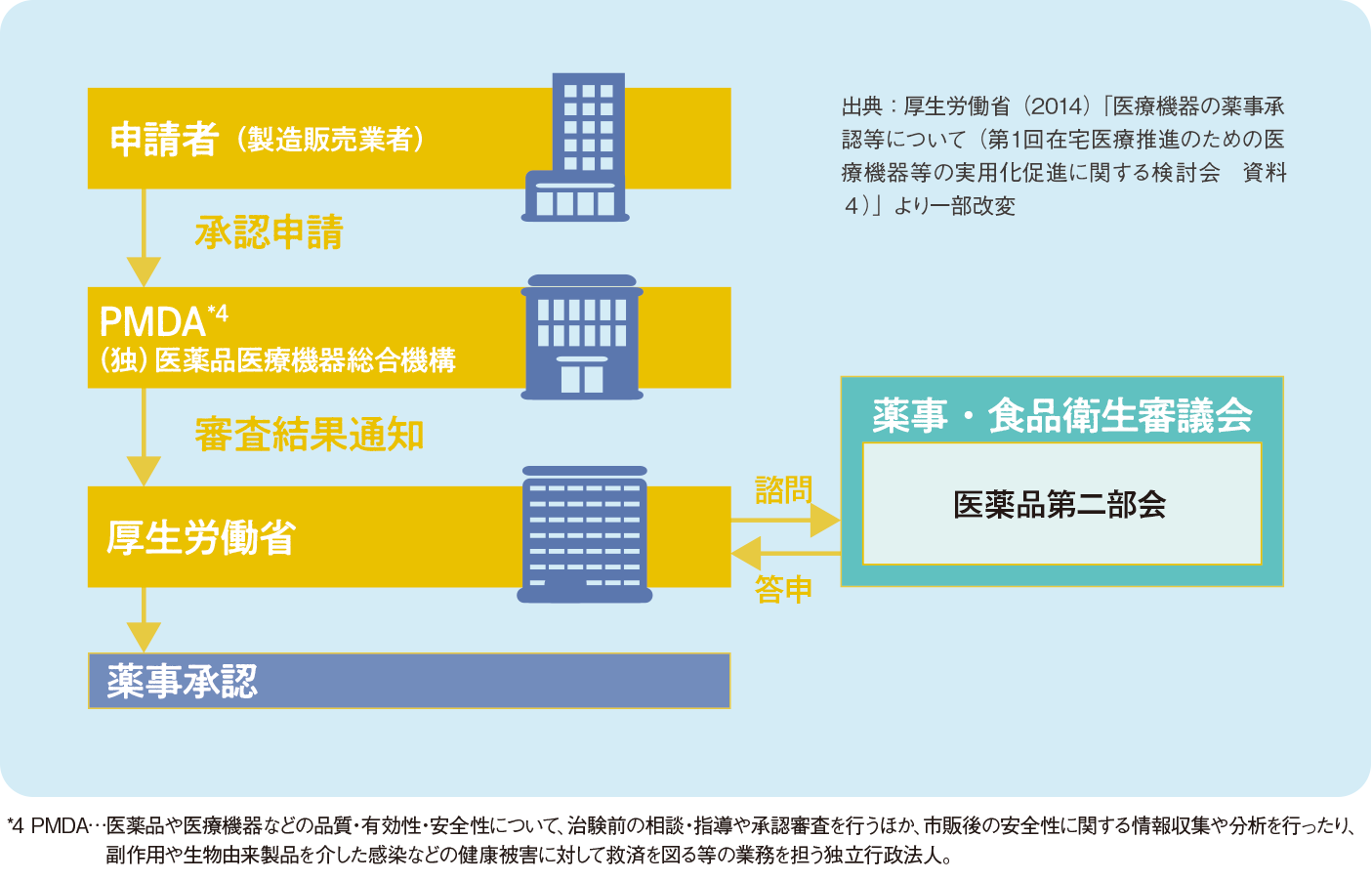
(クリックで拡大)
有効性・安全性を確認しつつ、迅速に承認を進める
ワクチンを含む医薬品は、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器等法)」(以下、薬機法)に基づいて、製造から販売、市販後の安全対策まで一貫した規制がかけられています。特に病原性の細菌やウイルスを原料とするワクチン類は、薬機法上の「生物由来製品」*5に指定されています*6。薬事承認後も、稀な副反応や効果の持続期間など、さらに詳しい情報収集や調査が行われます。そのほか、承認後一定期間が経過した後に、承認された有効性や安全性について再度確認を行う「再審査制度」も定められています。こうした様々な基準や法規制によって、ワクチンの有効性や安全性が保障されています。
承認までの審査期間は、通常の審査の場合およそ12か月*7を要しますが、「優先審査制度」や「先駆け審査指定制度」などの一定の基準を満たした品目については、早期承認を目指して優先的に審査が行われます。
また、新興感染症のパンデミックなど、疾病のまん延防止のために緊急の使用が必要で、その医薬品の使用以外に適切な方法がなく、日本と同等の水準の薬事制度を持つ国で承認されているなどの要件を満たす場合には、臨床試験の成績や添付文書記載事項以外の申請資料を承認後に提出してもよいなど、特例的な承認が行われることがあり、これを「特例承認」といいます。
2021年までに特例承認を受けたのは、2009年に流行した新型インフルエンザのワクチン2種類と、新型コロナウイルス感染症治療薬4種類、そして3種類の新型コロナワクチンの9品目です。
*5 生物由来製品…ヒトまたは動物の細胞・組織等に由来するものを原材料とする製品のこと。感染因子を伝播する恐れが完全には否定できないことから、その特質に応じた安全性確保のための措置を講じる必要がある。そのなかでも、感染症リスクの発生リスクが高いと考えられるものは「特定由来生物製品」に指定される。
*6 新型コロナウイルスワクチンのうち、ファイザー社の「コミナティ筋注」、モデルナ社の「スパイクバックス筋注」は病原体の一部を利用したものであり、生物由来製品・特定生物由来製品のいずれにも該当しない。
*7 医薬品医療機器総合機構(2019),「令和元年度のこれまでの事業実績と今後の取組みについて<審査・安全対策等業務>」

予防接種を支える仕組み(2)
定期接種ワクチンに関する検討の流れ

(クリックで拡大)
ワクチンの予防接種法上の位置付けについて検討を行う
予防接種は、主に定期接種と臨時接種、そして任意接種の三つに分かれます。定期接種と臨時接種は、予防接種法に基づいて国が接種を勧奨し、市区町村が実施するもので、接種費用は公費で賄われます。定期接種は対象年齢や接種期間が定められたもので、臨時接種は、今回の新型コロナウイルスワクチン接種のように、感染症のまん延防止のため緊急的に実施されるものです。任意接種は希望者が自主的に受けるもので、接種費用は原則自己負担となります。
2010年代には、日本はワクチン・ギャップの解消などに向け、予防接種制度の見直しを行うようになりました。定期接種のあり方についても、医学的・科学的根拠に基づいて検討を行う体制が整備されました。上の図はその体制を示したものです。新ワクチンが承認された際にも、国はこの体制のもと、法の上での位置付けについて速やかに検討することとなっています。
ワクチンの製造過程と安定供給への取り組み
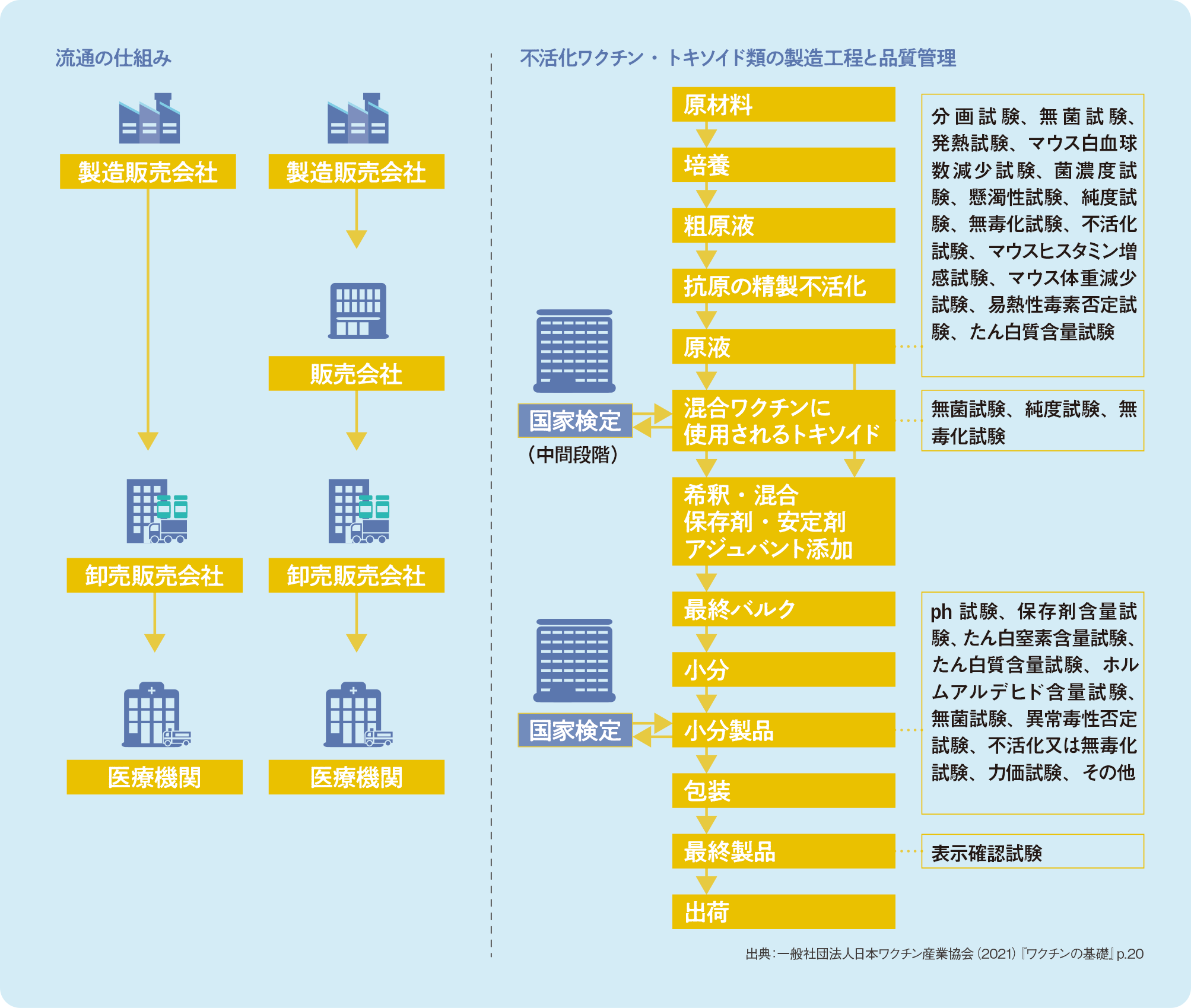
(クリックで拡大)
突発的なワクチン不足に備えるために
ワクチンの出荷までには多くの工程があり、各工程で様々な自家試験*8を行って国家検定を受ける必要があります。出荷されたワクチンは、各医療機関からの注文に応じて、各卸売業者の配送網に乗って届けられます。
必要な人にワクチンを接種するためには、ワクチンの安定的な供給体制が不可欠です。しかし、突発的な要因でワクチンが不足する事態はしばしば生じてしまいます。過去には、製造業者への業務停止命令や、2016年の熊本地震での製造工場の被災、麻しんの広域的発生等による需要増などで、ワクチンの一時的な供給不足が生じています。
製造業者は、必要数を上回るワクチンの在庫の確保や、一定量の原液の貯留を行っています。しかし、各業者が在庫を大量に抱えることは困難であり、原液からワクチンを製造して出荷するまでにも一定の時間がかかることから、需給バランスの大きな変動に即時に対応することは困難です。また、国全体では十分なワクチンが確保されていたとしても、地域レベルで偏在が生じてしまうこともあります。そのため、各関係機関で連携し、ワクチンの供給状況に関する情報を共有する仕組みを整備することが必要になります。
厚生労働省は、2021年から「ワクチンの流通情報の基盤整備に向けた検討会」を開催し、各メーカーや医療機関、自治体、卸売販売業者などがそれぞれ保有している情報を組み合わせて、ワクチンの偏在や不足の実態を正確にモニタリングする体制の構築を目指しています。また日本医師会では、2019年7月から「ワクチン納入状況報告システム」の運用を開始しています。
*8 自家試験…製造業者が自らの責任で行う試験検査のこと。

予防接種を支える仕組み(3)
接種までのオペレーション
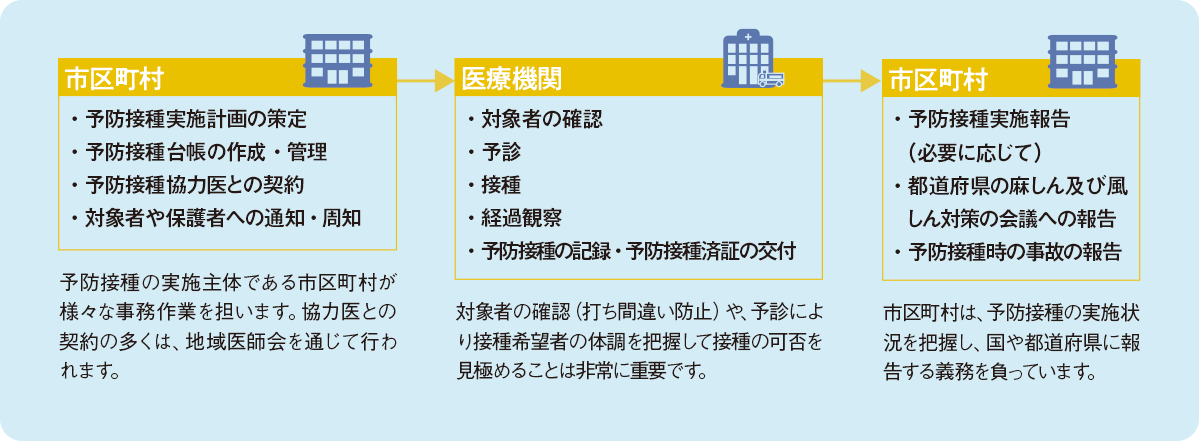
(クリックで拡大)
副反応疑い事例のモニタリングとフォロー
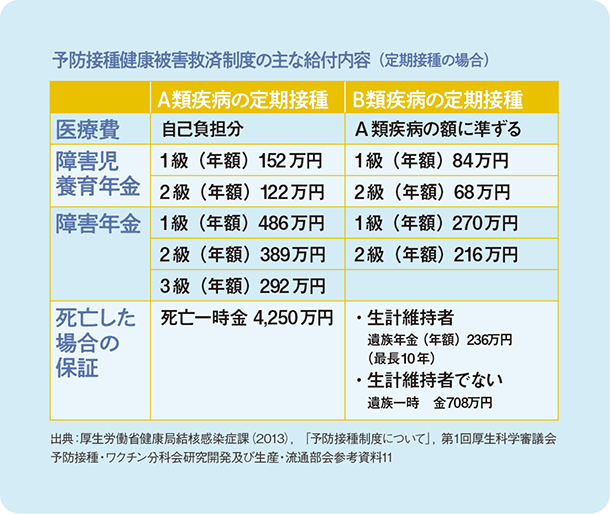

稀な副反応の監視と健康被害者の救済
ワクチンを接種した後には、様々な有害事象が生じることがあります。必ずしもワクチンとの因果関係が明らかでない場合もありますが、有害事象の事例を広範にモニタリングすることで、承認時には想定されていなかった稀な副反応などを探知し、ワクチンの安全性を見極めることができます。
医師や医療機関には、定期接種や臨時接種を受けた人が、アナフィラキシーなど報告基準に該当する症状を呈している場合、厚生労働大臣に報告することが義務付けられています*9。報告は、PMDA等で情報整理や調査がなされ、必要な措置がとられます。
予防接種による健康被害が生じることは、極めて稀ではあるものの、避けることはできません。そのため、重大な健康被害を受けた人に医療費や死亡一時金などが支払われる「予防接種健康被害救済制度」が設けられています*10。本人や保護者等による市区町村への申請があると、因果関係の審査が行われ、因果関係が認定されると給付が行われます*11。
*9 任意接種の場合も、重篤な副作用や後世代における先天性の疾病や異常、軽微ではなく添付文書等からも予測できない未知の症状などが発生した場合は報告の対象となる。
*10 定期接種の場合は予防接種法に基づく救済制度が、任意接種の場合はPMDAによる救済制度が設けられている。
*11 ワクチンとの因果関係が明確でない事例についても救済の対象となることがある。
COLUMN
予診や被接種者のフォローを担える医師に
 日本医師会常任理事 釜萢 敏
日本医師会常任理事 釜萢 敏
ワクチンの大規模接種の際には、接種の担い手だけでなく、予診をする医師の役割が非常に重要です。読者の皆さんも、ぜひ学生のうちから、予診の重要性に関心を持ってほしいです。また、ワクチン接種後に体調変化を来す方がいるということを理解し、適切な医療を提供できる医師になってほしいと思います。



- No.44 2023.01
- No.43 2022.10
- No.42 2022.07
- No.41 2022.04
- No.40 2022.01
- No.39 2021.10
- No.38 2021.07
- No.37 2021.04
- No.36 2021.01
- No.35 2020.10
- No.34 2020.07
- No.33 2020.04
- No.32 2020.01
- No.31 2019.10
- No.30 2019.07
- No.29 2019.04
- No.28 2019.01
- No.27 2018.10
- No.26 2018.07
- No.25 2018.04
- No.24 2018.01
- No.23 2017.10
- No.22 2017.07
- No.21 2017.04
- No.20 2017.01
- No.19 2016.10
- No.18 2016.07
- No.17 2016.04
- No.16 2016.01
- No.15 2015.10
- No.14 2015.07
- No.13 2015.04
- No.12 2015.01
- No.11 2014.10
- No.10 2014.07
- No.9 2014.04
- No.8 2014.01
- No.7 2013.10
- No.6 2013.07
- No.5 2013.04
- No.4 2013.01
- No.3 2012.10
- No.2 2012.07
- No.1 2012.04

- 医師への軌跡:根本 慎太郎先生
- Information:Winter, 2022
- 特集:予防接種を知る
- 特集:予防接種にまつわる歴史
- 特集:予防接種を支える仕組み
- 特集:日本の予防接種のこれから
- 同世代のリアリティー:獣医学生 編
- チーム医療のパートナー:障害者就労移行支援
- Blue Ocean:青森県|相馬 宇伸先生(弘前大学医学部附属病院)
- Blue Ocean:青森県|小玉 寛健先生(弘前大学医学部附属病院)
- 医師の働き方を考える:人々の命を救うため 現地のニーズに合わせた医療を提供する
- 日本医師会の取り組み:産業保健に関する日本医師会の取り組み
- グローバルに活躍する若手医師たち:日本医師会の若手医師支援
- 医学生大募集!ドクタラーゼの取材に参加してみませんか?
- 創刊10周年企画 これからのDOCTOR-ASE私とドクタラーゼ
- 創刊10周年企画 これからのDOCTOR-ASE座談会
- 日本医科学生総合体育大会:東医体
- 日本医科学生総合体育大会:西医体
- 授業探訪 医学部の授業を見てみよう!:札幌医科大学「地域医療合同セミナー1」
- 医学生の交流ひろば:1
- 医学生の交流ひろば:2
- FACE to FACE:宮地 貴士 × 菅野 勇太

